Back ميوغلوبين Arabic Mioqlobin Azerbaijani Миоглобин Bulgarian মায়োগ্লোবিন Bengali/Bangla Mioglobin BS Myoglobin Czech Myoglobin Danish Myoglobin German Μυοσφαιρίνη Greek Myoglobin English
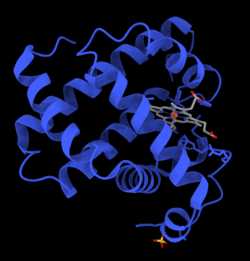
La mioglobina és una proteïna codificada en l'humà pel gen MB.[5] Presenta una estructura globular d'una sola cadena peptídica de 153 aminoàcids i amb un hemo (porfirina que conté ferro) que actua de grup prostètic situat el centre, al voltant del qual es doblega l'apoproteïna. Té vuit hèlixs alfa (de la A a la H) i un nucli hidròfob. Té un pes molecular de 16,700 daltons i és el principal pigment transportador d'oxigen al teixit muscular[6]

L'any 1958, l'equip de John Kendrew, en varen determinar l'estructura amb una cristal·lografia de la mioglobina de catxalot per mitjà de rajos X d'alta resolució.[8] El motiu principal és que aquesta proteïna es troba al catxalot en grans quantitats (en concentracions 10 vegades més elevades que al múscul dels mamífers terrestres), ja que aquest cetaci la utilitza durant les freqüents immersions submarines com a reserva d'oxigen. Per aquest descobriment, John Kendrew va compartir l'any 1962 el Premi Nobel de Química amb Max Perutz.[9] Tot i que és una de les proteïnes més estudiades en biologia, encara no se n'ha establert la vertadera funció fisiològica. En enginyeria genètica, els ratolins modificats amb una manca de mioglobina són viables, però presenten una reducció del 30% a la sortida sistòlica cardíaca. S'adaptaren a aquesta deficiència per mitjà de mecanismes genètics hipòxics i incrementant la vasodilatació.[10]
- ↑ 1,0 1,1 1,2 GRCh38: Ensembl release 89: ENSG00000198125 - Ensembl, May 2017
- ↑ 2,0 2,1 2,2 GRCm38: Ensembl release 89: ENSMUSG00000018893 – Ensembl, May 2017
- ↑ «Human PubMed Reference:». National Center for Biotechnology Information, U.S. National Library of Medicine.
- ↑ «Mouse PubMed Reference:». National Center for Biotechnology Information, U.S. National Library of Medicine.
- ↑ Akaboshi E (1985). "Cloning of the human myoglobin gene". Gene 33 (3): 241–9. PMID: 2989088
- ↑ G.eorge A. Ordway and Daniel J. Garry (2004). "Myoglobin: an essential hemoprotein in striated muscle". Journal of Experimental Biology 207: 3441–3446. doi:10.1242/jeb.01172. PMID: 15339940
- ↑ PDB 1MBO; Takano T (March 1977). "Structure of myoglobin refined at 2.0 Å resolution. II. Structure of deoxymyoglobin from sperm whale". J. Mol. Biol. 110 (3): 569–84. doi:10.1016/S0022-2836(77)80112-5. PMID: 845960
- ↑ JC Kendrew, G Bodo, HM Dintzis, RG Parrish, H Wyckoff, and DC Phillips (1958). "A Three-Dimensional Model of the Myoglobin Molecule Obtained by X-Ray Analysis". Nature 181 (4610): 662–666. doi:10.1038/181662a0. PMID: 13517261
- ↑ The Nobel Prize in Chemistry 1962
- ↑ Mammen PP, Kanatous SB, Yuhanna IS, Shaul PW, Garry MG, Balaban RS, Garry DJ (2003). "Hypoxia-induced left ventricular dysfunction in myoglobin-deficient mice". American Journal of Physiology. Heart and Circulatory Physiology 285(5): H2132–41. PMID: 12881221
© MMXXIII Rich X Search. We shall prevail. All rights reserved. Rich X Search